Российские вакцины не прошли все фазы клинического исследования?
Почему прививка от COVID-19 может быть только добровольной
От редакции сайта:
Согласно сообщению газеты «Известия»
«Пострегистрационные испытания вакцины от коронавируса «Спутник V», разработанной Центром им. Н.Ф. Гамалеи, планируется закончить в конце 2022 года. Такая информация содержится в реестре Минздрава. В документе обозначена дата начала испытаний 25 августа 2020 года и дата окончания — 31 декабря 2022 года».
Часть 2 статьи 21 Конституции РФ провозглашает: «Никто не может быть без добровольного согласия подвергнут медицинским, научным или иным опытам».
Понимая это, о добровольности вакцинации неоднократно говорил Президент России В.В.Путин, председатель Совета Федерации Федерального Собрания Российской Федерации В.И.Матвиенко и другие высокопоставленные чиновники России. На практике же при проведении вакцинации со стороны региональных чиновников имеют место многочисленные перегибы, различные формы принуждения граждан к вакцинации фактически не прошедшими до конца клиническое испытание препаратами и другие нарушения закона, об опасности чего предупреждал в своей статье председатель Конституционного суда РФ В.Д.Зорькин и писал в своем обращении на имя Президента России «Народный Собор».
Движение «Народный Собор» не выступает против вакцинации, как таковой. Но считает, что в сложившихся условиях она должна быть добровольной. Граждане России должны сами осознанно принимать решение о вакцинации, получив исчерпывающую информацию о всех возможных последствиях этого шага, консультироваться с врачами, учитывать наличие хронических заболеваний, способных привести к возможным различным осложнениям и даже летальному исходу после вакцинации.
В этом плане совершенно возмутительными являются действия главных санитарных врачей ряда регионов России, издавших распоряжение об обязательной вакцинации ( не прошедшей все стадии клинических исследований вакциной) всех граждан региона от 60 лет и старше, причем включая лиц с хроническими заболеваниями, в том числе с заболеваниями бронхолегочной системы, сердечно-сосудистыми заболеваниями, сахарным диабетом и ожирением. Это является явным превышением должностных полномочий и должно стать предметом пристального внимания со стороны правоохранительных органов. Ведь еще совсем недавно наличие таких заболеваний в целом ряде случаев считалось основанием для отказа от вакцинации ( по мнению многих независимых врачей эти факторы значительно усиливают негативные последствия от вакцинации). Недавняя смерь известного актера Валерия Гаркалина, дважды провакцинировавшегося при наличии у него тяжелого хронического заболевания, как и другие громкие подобные случаи, которые не удалось замолчать – яркое тому свидетельство.
В связи с этим для граждан, защищающих свои конституционные права при проведении кампании по вакцинации населения, еще раз публикуем статью из газеты «Аргументы недели».
Российские вакцины не прошли все фазы клинического исследования?
Клиническое исследование лекарственного препарата – изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека, животного на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами, кормами. (Федеральный закон от 12.04.2010 N 61-ФЗ “Об обращении лекарственных средств” Статья 4 Пункт 41)
Клинические исследования во всем мире являются неотъемлемым этапом разработки препаратов, который предшествует его регистрации и широкому медицинскому применению. В ходе клинических исследований новый препарат изучается для получения данных о его эффективности и безопасности. На основании этих данных уполномоченный орган здравоохранения принимает решение о регистрации препарата или отказе в регистрации.
Проведение клинических исследований в РФ регламентируют: Федеральный закон от 12.04.2010 N 61-ФЗ “Об обращении лекарственных средств” (Статья 40. Проведение клинического исследования лекарственного препарата для медицинского применения), ГОСТ Р 56701-2015 от 2016-07-01 ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ (УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 11 ноября 2015 г. N 1762-ст.), ГОСТ Р 52379-2005 от 2006-04-01 НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА (УТВЕРЖДЕН Приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 года N 232-ст), Правила надлежащей клинической практики ОСТ 42-511-99 (согласно международного стандарта этических норм и качества научных исследований Good Clinical Practice; GCP), Приказ Минздрава России от 01.04.2016 N 200н “Об утверждении правил надлежащей клинической практики” (Зарегистрировано в Минюсте России 23.08.2016 N 43357), приказ Минздрава России от 09.01.2014 № 2н «Об утверждении порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий».
Обычно выделяют четыре фазы клинических испытаний. Фаза I. Цель этапа — убедиться, что препарат можно применять у людей. Фаза II. Цель этапа — дополнительно оценить безопасность лекарства и выяснить, работает ли препарат. Фаза III. Цель этапа — сравнить новый препарат со стандартным лечением. Фаза IV называется постмаркетинговой — этот этап клинического испытания начинается, когда готовое лекарство уже поступает в продажу.
Существует государственный реестр лекарственных средств, который содержит перечень лекарственных препаратов, прошедших государственную регистрацию (Федеральный закон от 12.04.2010 N 61-ФЗ “Об обращении лекарственных средств” Статья 33), другими словами реестр разрешений на проведение клинических исследований (РКИ).
В настоящий момент, у Российской Федерации известно существование нескольких вакцин от коронавируса: «Спутник V» и «Спутник Лайт» («Гам-КОВИД-Вак», Национального исследовательского центра эпидемиологии и микробиологии имени Н. Ф. Гамалеи), «ЭпиВакКорона» (Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии Вектор» Роспотребнадзора), «КовиВак» (Федерального научного центра исследований и разработки иммунобиологических препаратов имени М.П. Чумакова Российской академии наук).
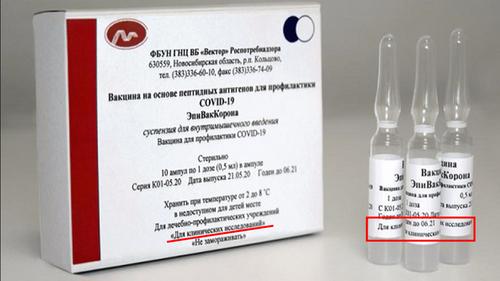
«ЭпиВакКорона» на сайте государственного реестра лекарственных средств.
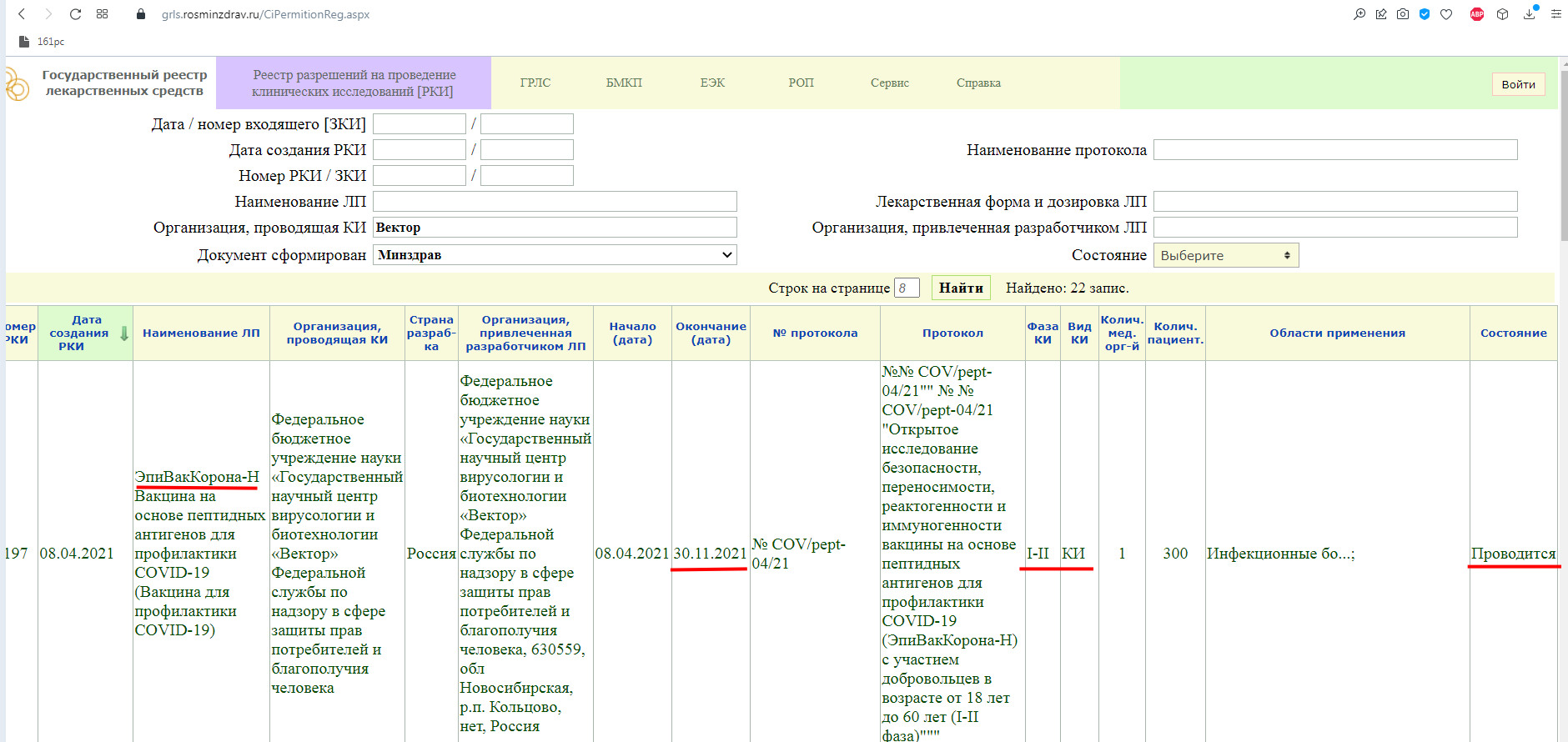
Как мы видим, в настоящий момент, проводится фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, и завершится она 30 ноября 2021 года.

Так же, проводится фаза клинического исследования 3-4 с участием добровольцев от 18 лет, и завершится она 31 августа 2021 года.

Завершенная фаза 3 клинического исследования, с участием добровольцев от 60 лет, и завершилась она 15 мая 2021 года.
Фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, проводится до 30 декабря 2021 года.
Далее «КовиВак» на сайте государственного реестра лекарственных средств.

Тут так же видно, что проводится фаза клинического исследования 3 с участием добровольцев от 18 до 60 лет, и завершится она 30 декабря 2022 года.
«Спутник Лайт» на сайте государственного реестра лекарственных средств.
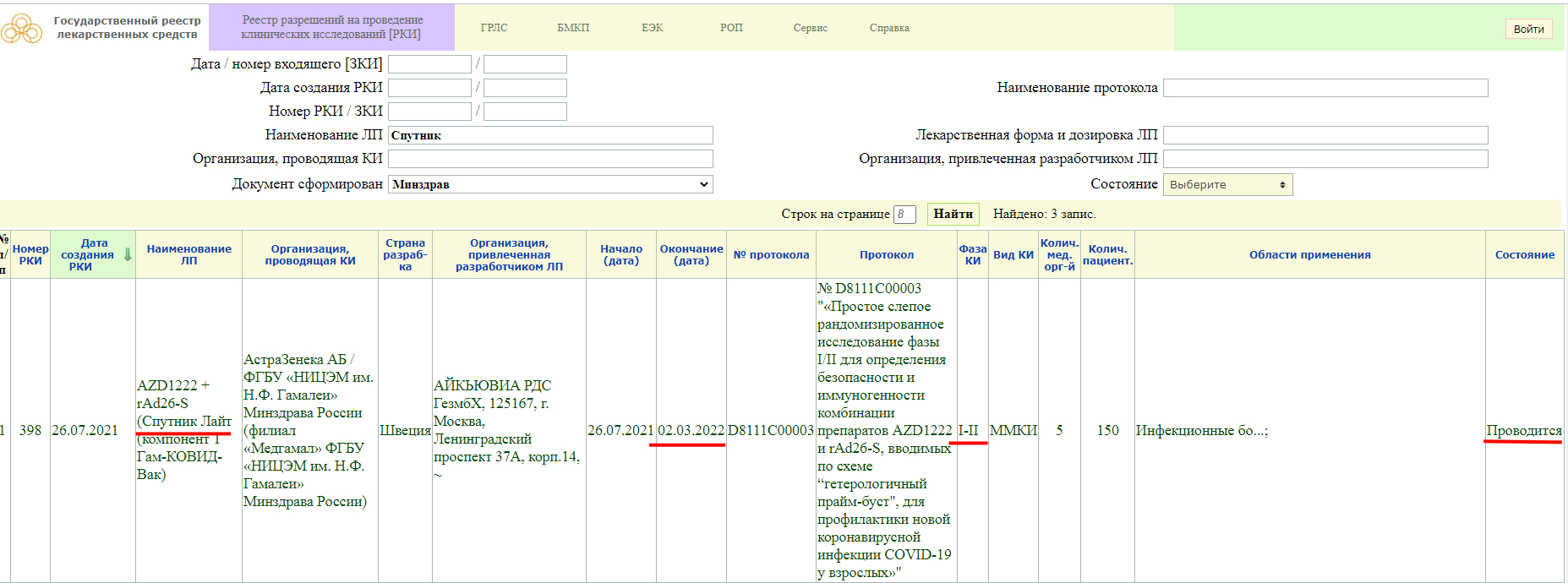
Как мы видим, в настоящий момент, у «Спутника Лайт» проводится фаза клинического исследования 1-2, и завершится она 2 марта 2022 года. Кстати обратите внимание, страна разработки Швеция.
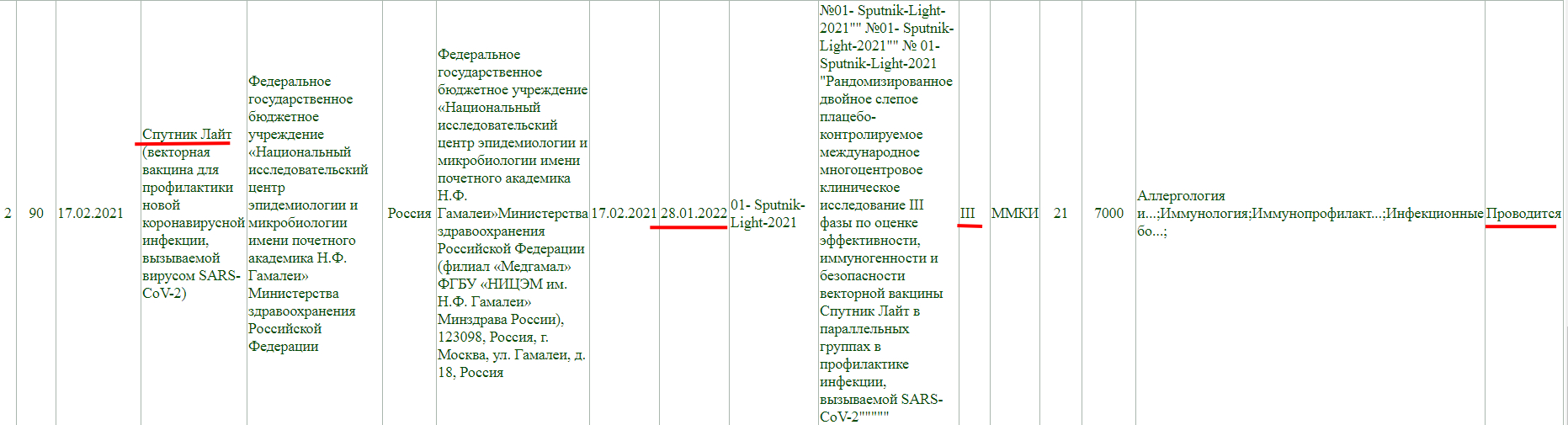
Так же, проводится фаза клинического исследования 3, и завершится она 28 января 2022 года.

Фаза клинического исследования 1-2, проводится до 31 декабря 2021 года.
В том числе и “Спутник V” («Гам-Ковид-Вак») на сайте государственного реестра лекарственных средств.
Важно отметить, что согласно разъяснениям Минздрава: «Гам-Ковид-Вак» и «Спутник V» – это одна и та же вакцина, у которой есть медицинское и коммерческое названия. Всем знакомая и понятная фраза «Спутник V» является торговым наименованием «Гам-Ковид-Вак.

Как и у остальных, клинические исследования не завершены, и в настоящий момент проводится фаза 3 с участием добровольцев от 18 до 60 лет, а завершится она 30 декабря 2022 года.
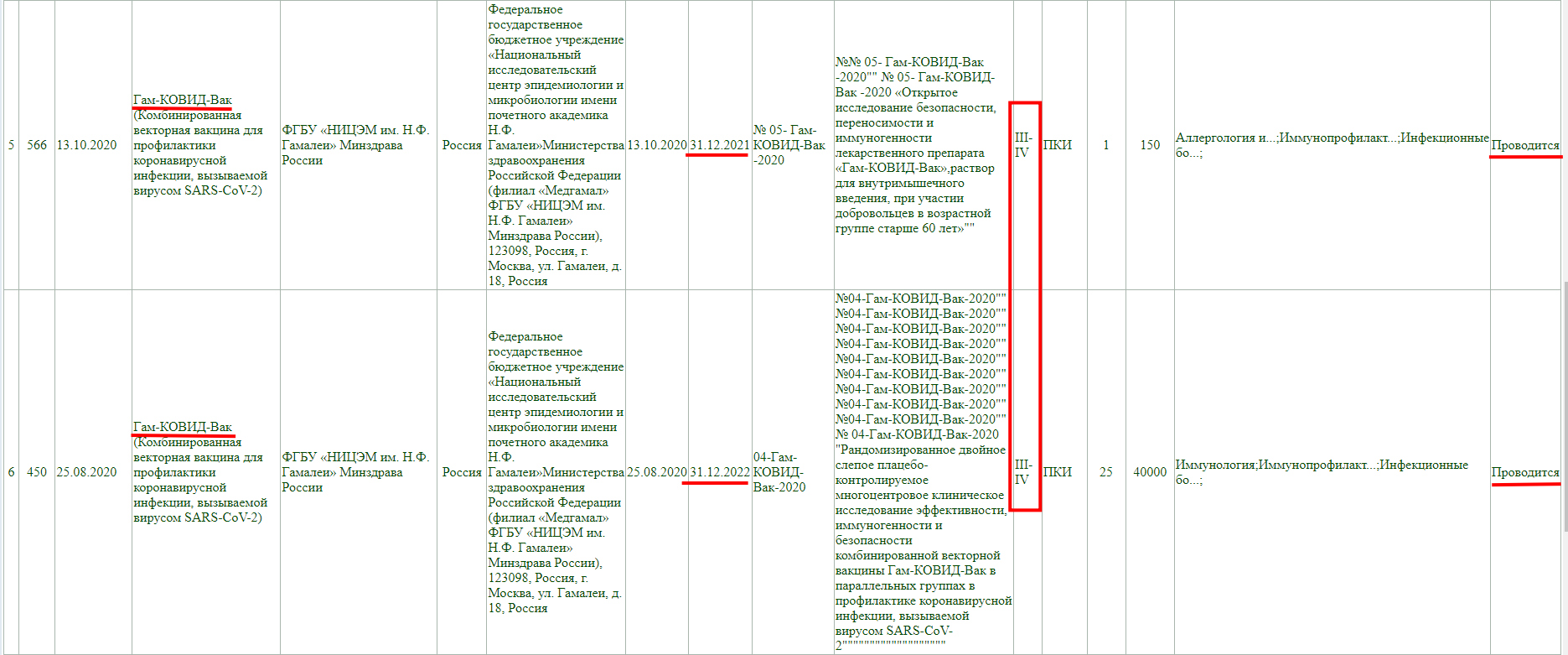
Тут аналогично, клинические исследования не завершены, проводится фаза 3-4, и завершится она 30 декабря 2022 года.
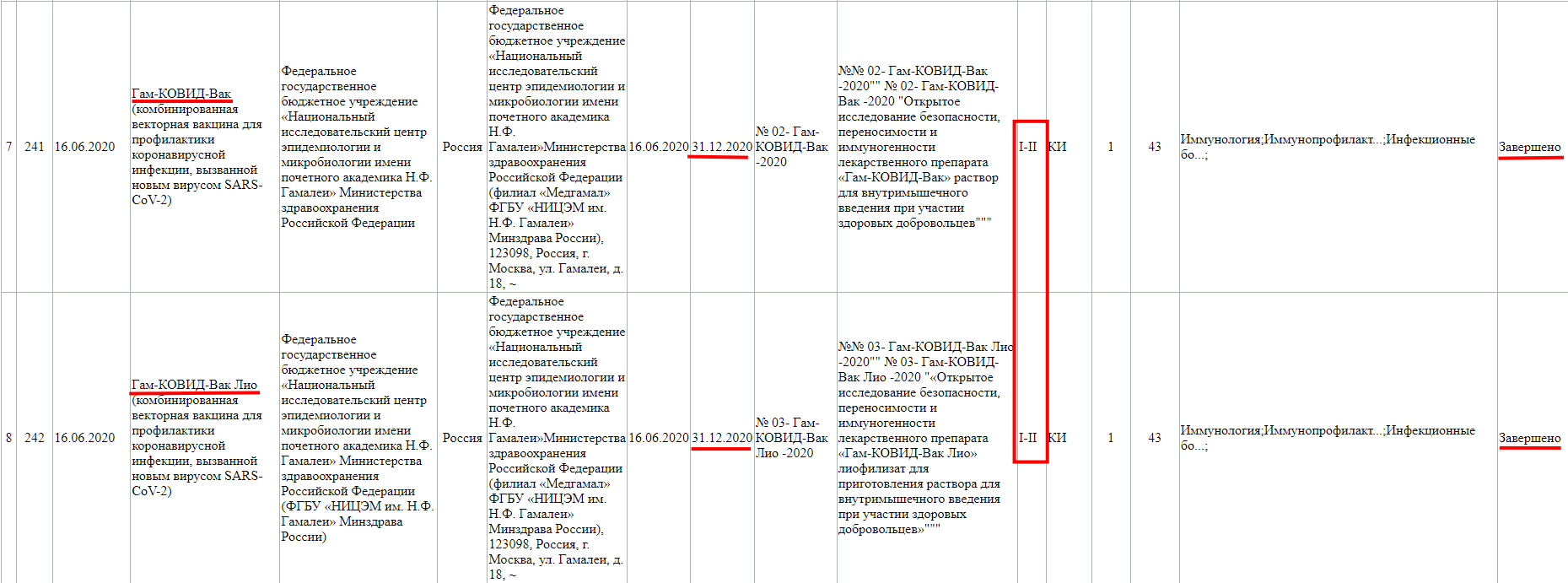
А тут клиническое исследование завершено, но только фазы 1-2.
Кроме того, отсутствие данных о клинических испытаниях вакцины «Спутник V» необходимых для ее регистрации в Европе, 15 мая 2021 года, уже сообщало одно из крупнейших в мире международных агентств новостей и финансовой информации, Reuters.
И в завершение, по данным ВОЗ на 14 марта 2021 г., российские вакцины против COVID-19, в перечне безопасных и эффективных, отсутствуют.
Константин Куликов